| 2021.08.06(金) |
細胞分析から膨圧変化に伴う蜜入りリンゴの 新たな代謝メカニズムが明らかに(愛媛大学/農研機構/ ブエノスアイレス大学) |
|---|
愛媛大学大学院農学研究科の和田博史教授、野並浩名誉教授、畠山友翔研究員、愛媛大学大学院連合農学研究科博士課程の中田佳佑、農業•食品産業技術総合研究機構(農研機構)基盤技術研究本部の高度分析研究センター環境化学物質分析ユニットの田中福代ユニット⻑、同果樹茶業研究部門 果樹生産研究領域 果樹スマート生産グループの立木美保上級研究員、ブエノスアイレス大学有機化学科•国家科学技術研究会議(CONICET)のロザ エラ•バルセルス教授の研究グループが、蜜入りリンゴ果実内の細胞レベルの代謝変化•水分の状態を空間的にとらえることに世界で初めて成功し、蜜入りのメカニズムの一端を明らかにした。
この研究成果は8月4日(水)にSpringer Nature Groupと南京農業大学が共同刊行する学術誌「Horticulture Research」の電子版で公表された。なお、本研究はJSPS科研費(20H02982及び19J13330)の支援を受けて行われた。
<発表雑誌>
掲載誌:Horticulture Research
DOI番号:10.1038/s41438-021-00603-1
題名:Direct evidence for dynamics of cell heterogeneity in watercored apples: Turgor-associated metabolic
modifications and within-fruit water potential gradient unveiled by single-cell analyses
著者:和田博史1,2,*,†, 中田佳佑2,†, 野並浩1, ロザ エラ-バルセルス3, 立木美保4, 畠山友翔1, 田中福代5,*
1 愛媛大学大学院農学研究科
2 愛媛大学大学院連合農学研究科
3 ブエノスアイレス大学有機化学科•国家科学技術研究会議(CONICET)
4 農研機構 果樹茶業研究部門 果樹生産研究領域果樹スマート生産グループ
5 農研機構 基盤技術研究本部 高度分析研究センター 環境化学物質分析ユニット*責任著者†共同筆頭著者
論文 URL:https://doi.org/10.1038/s41438-021-00603-1
この件のお問い合わせ先は国立大学法人 愛媛大学大学院農学研究科 食料生産学科植物工場システム学コース 植物細胞システム計測学教授 和田博史まで(電話089-946-9824 FAX089-946-9867 Email: hwada@agr.ehime-u.ac.jp)。若しくは国立研究開発法人 農研機構高度分析研究センター 環境化学物質分析ユニットユニット⻑ 田中福代まで(電話029-838-7351 FAX029-838-7352 Email: fukuyot@affrc.go.jp)。
<ポイント>
・通常果とは対照的に、蜜果の外側の非蜜部分から内側の蜜部分にかけて、空間的に細胞膨圧(注
1)が低下し、これに連動して蜜部分に向かって水の流れが生じている。
・膨圧低下に伴い、蜜部分で特異的に発酵代謝が進み、蜜独特の芳醇な香り成分である揮発性化
化合物が高濃度に蓄積している。
・これら部位特異的な反応により、蜜部分では本来細胞壁空間にあるべき空気層が消失し、水•揮
発性物質が蓄積した結果、光の乱反射が起きず、外観上透明化する。
- ・本成果は温暖化環境下での蜜入りリンゴの安定生産技術の開発につながる基礎知見である。
品種「ふじ」に代表される蜜入りリンゴは、一般的には低温により蜜形成が誘導され蜜入りリンゴは香しいフレーバーをもつ高付加価値果実として国内外で人気を博している。しかし、温暖化に伴う秋の気温上昇から、果実内の蜜入りの不安定化が懸念されている。蜜入りリンゴのメカニズムについては、果実内の細胞間隙への転流糖であるソルビトー ルの集積や、成熟に伴う細胞膜強度の低下を介する溶質蓄積に起因した水分の集積など、いくつかのメカニズムが提唱されてきた。しかし、これまで細胞レベルで水の動きと生理 代謝に注目してそれらを同時に調べられた事例はなく、蜜部分において何が起こっている かは明らかにはなっていませんでした。
研究の内容
今回の実験では、蜜果と通常の果実を用いて、愛媛大学で開発された1細胞の水の動きと網羅的な代謝産物の同時計測が可能なピコリットル•プレッシャープローブ•エレクトロスプレーイオン化質量分析法(注2)とともに、原理の異なる2つの浸透圧計測法(凝固点降下法(注3)、蒸気圧法(注4))を組み合わせて解析を行った。その結果、蜜果では通常の果実とは対照的な水分の動き•代謝の変化が起こり、それが原因となって蜜独特の香り•外観を持つに至っていることが明らかとなった。
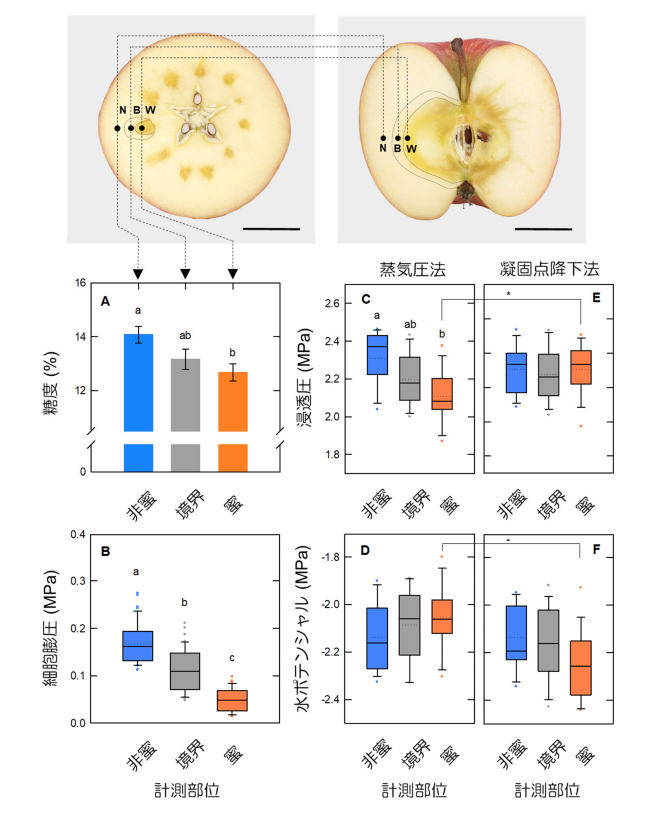
図1.蜜果リンゴの各計測部位(非蜜,境界,蜜部位)の水分状態計測
図中の異なるアルファベット、星印は有意差があることを示す。
細胞レベルの詳細な解析から、蜜果の蜜部分では糖度が低く、細胞の膨圧が特異的に低く維持されていた(図1A&B)。また膨圧低下に関連し、細胞内で発酵代謝が顕著に促進され、蜜の部分からその境界にかけて、アルコール類を主成分とする揮発性物質が高濃度に集積していることが明らかとなった(図2)。さらに水の動きを示す水ポ テンシャル(注5)を求めたところ、外側の非蜜部分から内側の蜜部分に向かって水の流れが生じていることが強く示唆された(図1E&F,図4)。
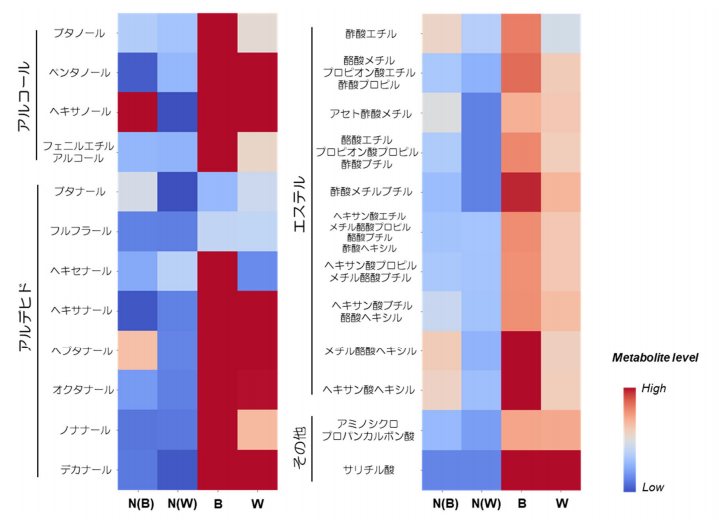
図2.非蜜果の各細胞(境界部(N(B))と蜜部(N(W))に相当する2領域)と蜜果の各細胞(境界部.
(B),蜜部(W))におけるヒートマップを用いた揮発性代謝物の比較
本研究では2つの原理の異なる浸透圧計を用いた。蒸気圧測定法は試料液中の不揮発性化合物のみの浸透圧を求めることができ、アルコールのような揮発性化合物の浸透圧 は検出できない。一方、凝固点降下法は揮発性化合物を含むすべての溶質の浸透圧を検出できる。これまで植物生理学の分野でこの違いに留意して研究された事例はありませんでした。特に蜜形成に関する過去の研究において、浸透圧計測は蒸気圧法を用いて行われることが多く、蜜部位の浸透圧が過小評価されていた可能性があった。
そこで2つの浸透圧計を併用して、人為的にリンゴ果汁にアルコールの主成分であるエタノールのモル濃度が50、100、150、200 mMになるように調整したモデル果汁液を用い、蒸気圧法による見かけの浸透圧と凝固点降下法による実際の浸透圧を測定、比較している。蒸気圧法で求めた浸透圧はエタノール濃度に関わらず、測定した範囲で浸透圧は同じ値でしたが、凝固点降下法で求めた浸透圧はエタノールの体積モル濃度と高い相関を示した(図3)。
この結果から揮発性物質の濃度が無視できない試料では、浸透圧測定値にずれが生じることが示された。図1D&Fに示した細胞の水分状態と水の流れの方向性を示す水ポテンシャルの値は、2つの浸透圧計の結果を踏まえ、見かけ上と実際の水ポ テンシャルとして求められている。図1Fに示すように,凝固点降下法による浸透圧計測を行ったことで、果実内の蜜部分に流れる真の水の流れを見出している。
非蜜部分では細胞壁空間に空気層が残っているため果実の外観が不透明になっている。これに対して、蜜部分では上述のメカニズム(揮発性物質の細胞壁空間への蓄積と細胞壁を通る水の流れ)で空気層がなくなり、細胞壁空間にアルコール•水がたまった結果、光が乱反射せず、外観上、切断面が透明化することが明らかになった(図4)。
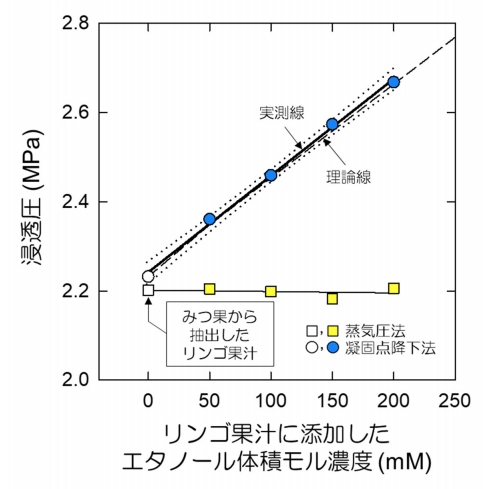
図3.リンゴ果汁に人為的に添加したエタノールの体積モル濃度に対する蒸気圧法及び
凝固点降下法で決定した溶液の浸透圧
<今後の展開>
本研究は、水の動き•代謝の同時計測という最新の1細胞計測技術を実際の果樹生産現場の課題である蜜入りリンゴの機構解明に応用し、その機構の一端を明らかにした。本知見は温暖化環境下での蜜入りリンゴ安定生産のための技術開発につながる基礎的な知見だ。今後,細胞の膨圧と発酵代謝の関係性に注目しながら、蜜形成に至る継時変化など、更なる研究データの蓄積が必要になる。

図4.蜜症発生に伴うリンゴ果実内の細胞の膨圧の分布と水の流れ
pは細胞膨圧、πは浸透圧、VBは維管束、Xyは導管、EtOHはエタノール、⻘線は水の流れを示す。図中の細胞の膨圧( p)の上付き文字、Low、Mid、Highは膨圧の大きさを示し、凝固点降下法で測定した浸透圧には部位間で差がないものの、膨圧については「蜜部位<境界部<正常部位」の傾向があり、外側から蜜部位にかけて水の流れがあることを示す(本文参照)。
<用語解説>
注1 細胞膨圧
植物の細胞において細胞壁に対して働く力(圧力)である。細胞膨圧は細胞拡大、気孔制御、 果実軟化、代謝活性の維持等に密接に関わる生理学的に重要なパラメーターである。プレッシャープローブ計測では、シリコンオイルが充填されたキャピラリーの先端を1植物細胞に突き刺すことで
細胞の膨圧を計測することができる。
注2 ピコリットル•プレッシャープローブ•エレクトロスプレーイオン化質量分析法
1植物細胞における非破壊水分状態(膨圧)計測器であるプレッシャープローブと高感度かつ高精度な代謝プロファイリングが可能なエレクトロスプレーイオン化オービトラップ質量分析計を組み合わせた1細胞生体計測法である。プレッシャープローブを用いると、植物細胞の水分状態を計測後、代謝産物を含むピコリットルレベルの超微量の細胞溶液を試料として採取することができる。この採取した細胞溶液に高電圧を直接印加することにより、前処理の必要なくリアルタイムに直接代謝産物分析できる。本手法は愛媛大学の同グループで開発された手法(下記文献参照)である。
注3 凝固点降下法による溶液の浸透圧計測
希薄溶液の束一的性質のひとつである凝固点降下(試料溶液の凝固点降下度は重量モル濃度の総和に比例)に基づき、プレッシャープローブで採取した植物細胞溶液を凍結•解凍し、溶液中に含まれるすべての溶質(不揮発性化合物+揮発性化合物)を対象にその凝固点を計測することで浸透圧を求めることができる。本研究では計測器としてナノリッター浸透圧計を用いた。
注4 蒸気圧法による溶液の浸透圧計測
希薄溶液の束一的性質のひとつである蒸気圧降下(試料溶液中の不揮発性の溶質のみの濃度に比例して、相平衡に達した際の気相の水蒸気圧が減少する性質;ラウールの法則)に基づき、定温定圧条件下で気相中の水蒸気分圧(湿度)を計測することにより浸透圧を求めることができる。本研究では計測器として等圧式サイクロメーターを用いた。
注5 水ポテンシャル
水分の状態を示す指標として植物生理学分野で計測されるパラメーターである。水の化学ポテンシャルを水の部分モル体積で割った水が持つエネルギー量を示し、純水を基準としてどれだけエネルギー的な化学ポテンシャル差があるか量的に示すことができる。植物細胞の水ポテンシャルは膨圧から浸透圧を差し引くことで求まり、値はマイナスの符号のついた負の圧力値として示される。
<参考文献>
Nakashima, T. et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Analytical Chemistry 88, 3049-3057, doi:10.1021/acs.analchem.5b03366 (2016).